Твердые металлы имеют кристаллическое строение. Для кристаллов характерно наличие дальнего порядка в расположении атомов, т.е. в кристаллах существует строго определенное геометрически правильное расположение атомов, которое наблюдается на любом расстоянии от произвольно выбранного атома.
При плавлении кристаллов дальний порядок нарушается и образуется ближний порядок в расположении атомов, т.е. в расплаве сохраняется некоторая упорядоченность лишь вблизи произвольно выбранного атома, по мере удаления от данного атома степень упорядоченности быстро падает. Поэтому переход кристаллического вещества из жидкого состояния в твердое заключается в установлении дальнего порядка в расположении атомов.
Переход из жидкого состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией.
Изменение свободной энергии металла в жидком и твердом состоянии в зависимости от температуры показано на рисунке 8.
Система, состоящая из большого числа атомов, стремится к такому состоянию, которому в данных условиях соответствует минимальное значение величины свободной энергии. Если вещество может существовать в жидком и твердом кристаллическом видах, то устойчивой в данных условиях будет та фаза, которая обладает меньшей величиной свободной энергии.
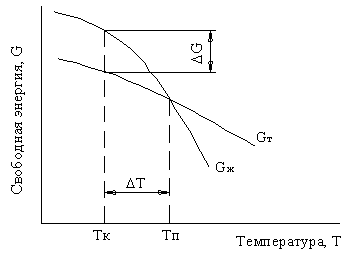
Рисунок 8 — Изменение свободной энергии металла в жидком Gж и твердом Gт состоянии в зависимости от температуры
При температурах выше равновесной температуры плавления Тп меньшей свободной энергией обладает жидкая фаза, а ниже этой температуры — твердая фаза. При температуре Тп обе фазы могут существовать одновременно. Процесс кристаллизации при этой температуре еще не начинается. Он может протекать только при переохлаждении металла ниже равновесной температуры Тп, когда возникает разность свободных энергий DG (при температуре кристаллизации Тк).
Разность между температурами Тп и Тк называется степенью переохлаждения:
DТ = Тп — Тк.
Чем больше степень переохлаждения DТ, тем больше разность свободных энергий DG и больше скорость кристаллизации. При температурах, близких к температуре плавления, в жидком металле возможно образование небольших группировок, в которых атомы упакованы так же, как в твердом металле. Такие группировки называются фазовыми флуктуациями.
Фазовые флуктуации, имеющие размер выше критического, способные расти путем присоединения к себе атомов из жидкого расплава, называются зародышами, или центрами кристаллизации.
Флуктуации, имеющие размер меньше критического, расти не могут, они нестабильны и растворяются в жидкой фазе.
Если принять, что зародыш имеет форму куба с ребром А, то его критический размер, способный к росту, определяется:
Акр = 4s / DG,
где s — поверхностное натяжение.
Чем ниже температура кристаллизации, тем меньше критический размер зародыша, тем больше число центров кристаллизации (ч.ц.) образуется в единицу времени, тем больше скорость кристаллизации (с.к.).
Процесс кристаллизации начинается с образования кристаллических зародышей и продолжается в процессе роста их числа и размеров.
Пока образовавшиеся кристаллы растут свободно, они имеют более или менее правильную геометрическую форму. Однако при столкновении их правильная форма нарушается, так как в этих участках рост граней прекращается. Рост продолжается только в тех направлениях, где есть свободный доступ ”питающей” жидкости. В результате образуется структура с кристаллами неправильной формы — зернами или кристаллитами.
При прочих равных условиях скорость процесса кристаллизации и строение металла зависят от числа центров кристаллизации, возникающих в единицу времени и в единице объема (мм-3∙с-1) и скорости их линейного роста (мм/с). Схема кристаллизации приведена на рисунке 9.
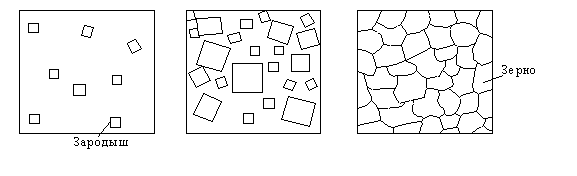
Рисунок 9 — Схема кристаллизации металла
Г. Тамман установил зависимость числа центров кристаллизации и скорости роста кристаллов от степени переохлаждения (рисунок 10).
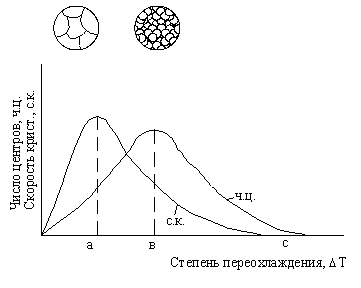
При DТ = 0 процесс кристаллизации не идет, скорости образования зародышей и их роста равны нулю. При DТ = а число центров кристаллизации небольшое, а скорость их роста максимальна. В этом случае структура металла будет крупнозернистой. При DТ = в число центров — максимально, а скорость их роста мала. Структура металла — мелкозернистая. При больших степенях переохлаждения DТ = с скорость кристаллизации и число центров равны нулю. Подвижность атомов уже недостаточна для того, чтобы осуществлялась их перестройка из хаотического расположения в жидкости в правильное в кристалле. Структура металла — аморфная. Для получения аморфных металлов (металлические стекла) нужны скорости охлаждения порядка миллионов градусов в секунду.
Такие скорости охлаждения достигаются при разбрызгивании мелких капель жидкого металла на хорошо отполированную поверхность быстро вращающегося холодного медного диска. Толщина пленки аморфного металла достигает нескольких микрометров (до 60 мкм) и ширины 200 мм, или проволоки диаметром 0,5…20 мкм. Другой вариант — прокатка тонкой струи расплава между двумя массивными медными валками, расплющивающие капли жидкого металла. При нагреве аморфный металл может реализовать свое стремление к кристаллизации и при достаточной подвижности атомов образуется кристаллическое строение.
Аморфный металл обладает рядом уникальных свойств из-за отсутствия границ зерен и дефектов кристаллического строения (например, дислокаций). Прочность их превосходит самые лучшие легированные стали (~3000 МПа). Высокая твердость определяет их великолепную износостойкость. Правда, пластичность аморфных металлов низка, но выше, чем у обычного стекла. Их можно, например, прокатывать при комнатной температуре. Другое важнейшее преимущество — их исключительно высокая коррозионная стойкость. Во многих весьма агрессивных средах (морской воде, кислотах) они вообще не корродируют. Аморфные сплавы на основе ферромагнитных металлов (железа, никеля) также ферромагнитны, электросопротивление их гораздо выше, чем кристаллических (обычно в 2…3 раза). Получение аморфной структуры в принципе возможно для всех металлов. Наиболее легко аморфное состояние достигается в сплавах Аl, Рb, Sn и др. Для получения металлических стекол на базе Ni, Co, Fe, Mn, Cr к ним добавляют неметаллы или полуметаллические элементы С, Р, Si, B, As, S и др.
Аморфные сплавы, например, на основе железа Fe80B20, Fe80P13C, Fe60Cr6Mo6B28; на основе никеля Ni82P18, Ni80S20.
Перспективы практического использования аморфного состояния металлов выглядит очень внушительно еще и потому, что уже создана аморфизация тонких поверхностных слоев массивных изделий. При воздействии на поверхность изделия мощного лазерного или электронного луча удается в короткое время расплавить очень тонкий наружный слой, который после прекращения воздействия остывает с огромной скоростью за счет отвода тепла в толщу холодного металла. Таким образом, обычный кристаллический металл, вероятно, можно будет надежно защитить от износа и коррозии.