Из всех элементов Периодической системы Д.И. Менделеева 76 составляют металлы. Все металлы имеют общие характерные свойства, отличающие их от других веществ. Это обусловлено особенностями их внутриатомного строения.
Согласно современной теории строения атомов, каждый атом представляет сложную систему, которую схематично можно представить состоящей из положительно заряженного ядра, вокруг которого на разном расстоянии от него движутся отрицательно заряженные электроны.
Притягивающее действие ядра на внешние (валентные) электроны в металлах в значительной степени скомпенсировано электронами внутренних оболочек. Поэтому валентные электроны легко отрываются и свободно перемещаются между образовавшимися положительно заряженными ионами.
Слабая связь отдельных электронов с остальной частью атома и является характерной особенностью атомов металлических веществ, обусловливающей их химические, физические и механические свойства. Общее число не связанных с определенным атомом электронов в различных металлах неодинаково. Этим объясняется довольно значительное различие в степени ”металличности” отдельных металлов. Наличием электронного газа объясняют и особый тип межатомной связи, присущей металлам.
Металлический тип связи характеризуется тем, что между решеткой из положительно заряженных ионов и окружающими их свободными валентными электронами возникает электростатическое притяжение.
Наличие в металлах металлической связи придает им ряд характерных свойств: высокую тепло- и электропроводность; повышенную способность к пластической деформации; термоэлектронную эмиссию, т. е. способность испускать электроны при нагреве; хорошую отражательную способность, т.е. обладают металлическим блеском и непрозрачны; положительный температурный коэффициент электросопротивления, т.е. с повышением температуры электросопротивление металлов увеличивается.
Последнее свойство присуще только металлам, поэтому:
Металл это вещество, имеющее металлический тип связи и положительный температурный коэффициент электросопротивления.
Сила связи в металлах определяется соотношением между силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, чтобы энергия взаимодействия была минимальной (рис. 1). Сближение атомов (ионов) на расстояние меньше R0 или удаление их на расстояние больше R0 осуществимо лишь при совершении определенной работы против сил отталкивания или притяжения.
В качестве модели такого взаимодействия (рисунок 1, б) можно принять два шара (ионы), между которыми находится пружина (сила взаимодействия). В состоянии равновесия расстояние между шарами R0. Если расстояние уменьшить и сжать пружину, то между шарами появится сила отталкивания (F), которая будет стремиться вернуть их в равновесное состояние. При увеличении расстояния появится сила притяжения (-F).
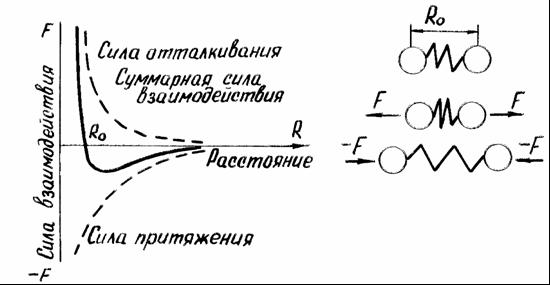
а б
Рисунок 1 — Силы взаимодействия двух атомов в кристаллической решетке (а) и модель такого взаимодействия (б)
В связи с этим атомы в металлах располагаются закономерно на определенном расстоянии друг от друга, образуя правильную кристаллическую решетку.
Ее следует представлять как мысленно проведенные в пространстве в направлении трех осей координат прямые линии, соединяющие ближайшие атомы и проходящие через их центры, около которых они совершают колебательные движения. Проведенные линии образуют объемные фигуры правильной геометрической формы.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме называется элементарной кристаллической ячейкой.
Размеры кристаллической решетки характеризуются параметрами или периодами решетки. Расстояние между центрами соседних атомов измеряется ангстремами (1 Å=10-10 м), килоиксами (1 кХ=1,00202 Å), нанометрами
(1 нм=10-9 м). Период решетки металлов находится в пределах 1…7 Å.
Половину наименьшего расстояния между центрами атомов называют атомным радиусом.
Плотность кристаллической решетки, объем занятого атомами, характеризуется координационным числом.
Число атомов, находящихся на равном и наименьшем расстоянии от данного атома, называется координационным числом.
Чем выше координационное число, тем больше плотность упаковки атомов. Для кубической ячейки координационное число обозначается буквой ”К”, а гексагональной — ”Г“.
Число атомов, приходящихся на одну элементарную ячейку, называется базисом.
Базис решетки обозначается буквой ”n“. Основными видами ячеек (рисунок 2), которые имеют металлы, являются: кубическая объемноцентрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
На одну элементарную ячейку ОЦК приходятся два атома (n=2): один в центре куба, а другой вносят атомы, располагающиеся в вершинах куба. Каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам, и на данную ячейку приходится лишь 1/8 часть, а на всю ячейку (1/8)х8=1 атом. Координационное число считается для центрального атома и соответствует К8.
На одну элементарную ячейку ГЦК приходится четыре атома (n=4): из них один вносят атомы в вершинах куба, а три суммарно вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит одновременно двум ячейкам: (1/2)х6=3. Координационное число считается для атома, расположенного в центре грани, и соответствует К12.
На одну элементарную ячейку ГПУ приходится шесть атомов (n=6): из них три находятся внутри ячейки. Два атома в центре граней дают один атом: (1/2)х2=1, а двенадцать вершинных атомов — два атома: (1/6)х12=2. Координационное число считается для атома, расположенного внутри ячейки, и соответствует Г12.