Алюминий по объему производства занимает 3-е место после сталей и чугуна: tпл = 660°С.
По распространенности в земной коре: Аl = 8,8%; Fe – 4,65%; Mg – 2,1%; Ti – 0,63%. Обладает коррозионной стойкостью. В чистом виде используют в электротехнической и пищевой промышленности, в машиностроении в виде сплавов.
В рудах содержится в виде глинозема Аl2O3: бокситы, нефелины, алуниты, глины, каолины.
1) Выделение из руды окисла Аl2O3:
- для этого руду подвергают выщелачиванию различными растворами (Na2CO3 и НСО3), остается Аl(ОН)3;
- далее Аl(ОН)3 подвергаются сушке и прокалке при температуре 1150–1200°С: 2Аl(OH)3 → Al2O3 + 3H2O.
Окисел Аl2О3 очень тугоплавкий имеет tплав до 2000°С.
2) Аl получают электролизом (рисунок 1.7) электролизере: в качестве электролита служит криолит – Na3AlF6, ведется при U = 4,5-5 В; J = 100000 А. На 1 т Аl затрачивается – 1,92-1,98 т Аl2O3; 0,08-0,09 т – криолита; 17500-18500 кВт·ч электроэнергии.
Электролит постоянным током нагревается до рабочей температуры 930–950°С. Криолит позволяет снизить температуру плавки. Получают Аl чистотой 98÷99,9%.
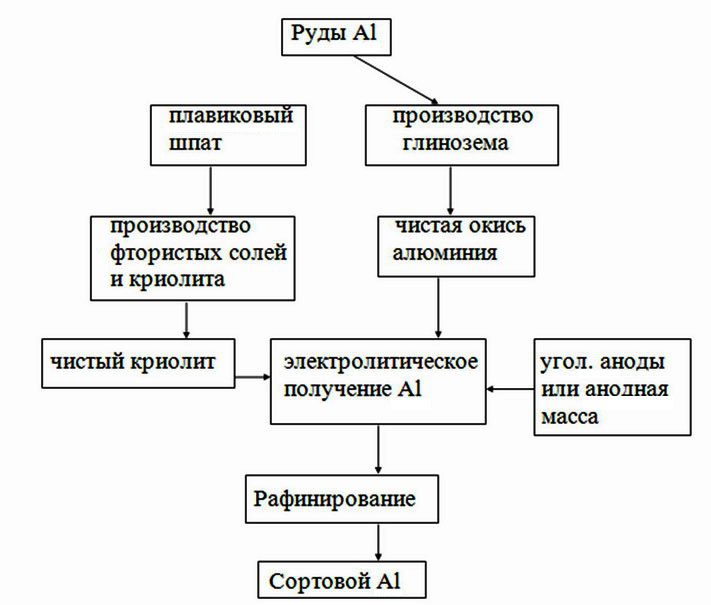
Рисунок 1.7 – Общая схема получения Аl